Atommodelle
Verfasst von Steffen Welsch und Danny Kieschnick
19.1 Atommodelle: wichtigste:
Thomson
Annahme: Jeweils negativ geladene Teilchen in der Größenordnung des Atomgewichtes wie Rosinen in einem positiv geladenen Kontinuum wie ein nach außen neutraler Pudding.
→ Konnte viele Beobachtungen deuten, versagte jedoch bei der Deutung von Spektrallinien!
Rutherford
(1910):

Aus dem Rutherford-Experiment konnte berechnet weden, dass der Kernradius etwa 10 000 bis 100 000 mal kleiner ist, als der Atomradius und etwa 10^-15 beträgt.
Rutherford-Experiment:
Hierbei wird eine Goldfolie mit Heliumkernen beschossen, die viel schwerer als Elektronen sind. Aus ihren Ablenkungen konnte Rutherford dann die oben angegebenen Werte berechnen.
Atommodell nach Rutherford:
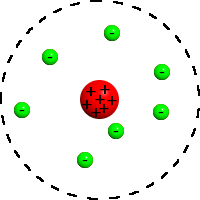
Bohr
(1913): Emmisions- und Absorptionsprozesse: BILDER NTARIMDAMPF 19.3-5 Atome können Energie aufnehmen und abgeben! Ergebnis: → Im Gas fand eine Absorption des Lichts einer bestimmten Frequenz statt. Die Atome haben Energie aufgenommen und anschließend wieder abgegeben. Anhand der beobachteten Farbe kann man bestimmen, wieviel Energie die Atome aufgenommen, beziehungsweise abgegeben haben:(formuliert von Planck)
Nach Absorption → energiereicherer Zustand Nach Emission → energieärmerer Zustand
Grenzen des Bohrschen Atommodells
Kapitel 23.1 - Grenzen des Bohrschen Atommodells
| Bohr | Widerspruch |
|---|---|
| Elektronen der untersten Bahn haben Drehimpuls und magnetische Momente. | Wasserstoff hat weder Drehimpuls noch magnetisches Moment → keine korrekte Beschreibung magnetischer Eigenschaften der Materie |
| Das 1. Postulat besagt, dass sich die Elektronen auf stabilen Bahnen um den Kern bewegen, das heißt, dass sie keine Energie abstrahlen. | Jedes um den Kern kreisendes Elektron ist ein schwingender Dipol. Es müsste Energie abstrahlen. Bohr begründet diesen Widerspruch nicht. |
| Mit dem Bohrschen Atommodell lassen sich Energieniveaus von Atomen mit mehreren Elektronen berechnen. | Diese Berechnungen stimmen nicht mit den experimentellen Werten überein.
Es gibt keine Aussage über Intensität und Polarisation der emittierten elektromagnetischen Strahlung. |
